Detección de Displasias Corticales mediante IRM sensibles a Difusión en un Modelo Animal
Introducción
La detección temprana de lesiones epileptogénicas como las displasias corticales es indispensable para poder mejorar el diagnóstico y tratamiento de trastornos epilépticos. Usar un modelo animal de displasias corticales evita la variabilidad de muchos factores que dificultan dicha patología en humanos; particularmente la heterogeneidad espacial de las displasias focales. A pesar de que existen otros métodos de neuroimagen capaces de evidenciar las láminas de la corteza in vivo, la metodología IRMd aventaja a técnicas como las imágenes T\(_1\) con contraste de Manganeso (por su toxicidad en humanos) o a la relaxometría (por sus extensos tiempos de adquicisión para la clínica).
Objetivo
Utilizar técnicas de IRM sensibles a difusión (IRMd) para mejorar la detección de displasias corticales mediante la descripción del patrón tridimensional de la difusión de las moléculas de agua con los parámetros provistos por IRMd relacionados a la micro-arquitectura del tejido.
Métodos
Sujetos
Para inducir displasias corticales en el grupo lesionado se inyecta a ratas Sprague-Dawley hembra de dos meses de edad, vía i.p., una dosis de BCNU (20 mg/kg en solución salina + 5 % de glucosa) a los 15 días de gestación. El grupo BCNU (n=16) está conformado por las crías de estas ratas; las crías de ratas inyectadas con solución salina forman el grupo control (n=16).
Se realizó un estudio de IRMd al día P30 a ambos grupos en el resonador Bruker de 7 Teslas del LANIREM. Los parámetros para la adquisición de IRMd eco-planar fueron TR = 2000 ms, TE = 22.86 ms, resolución de 0.175×0.174×1.25 mm\(^3\), tamaño de la matriz × número de rebanadas = 126x86x25, FOV = 22×15 mm; 90 direcciones de gradiente para cada valor b = (670, 1270, 2010) \(s/mm^2\) y 15 adquicisiones para b = 0.
A partir del modelo DTI se calculan mapas de fracción anisotrópica (FA), coeficientes de difusión aparente (ADC), difusión axial (AD) y difusión radial (RD). Se utilizó la función mincLaplace del toolkit del Mouse Imaging Center para construir streamlines ortogonales a las láminas corticales. Después de generar máscaras para un hemisferio de la corteza, se obtienen streamlines que parten desde la superficie pial hasta su correspondiente región estructural en la superficie cortical interna. Se muestrean luego los valores de los mapas de difusión a lo largo de las streamlines (figura 1).
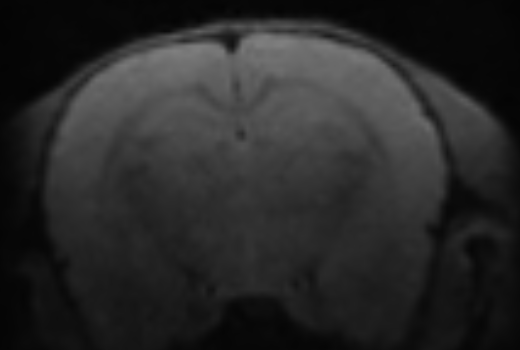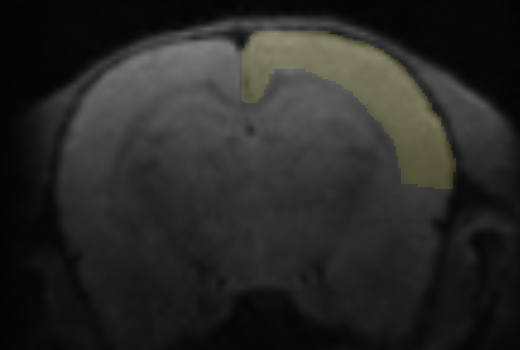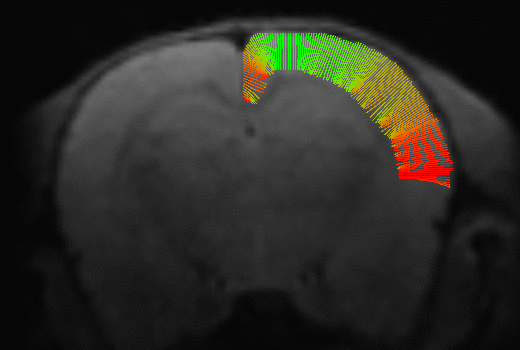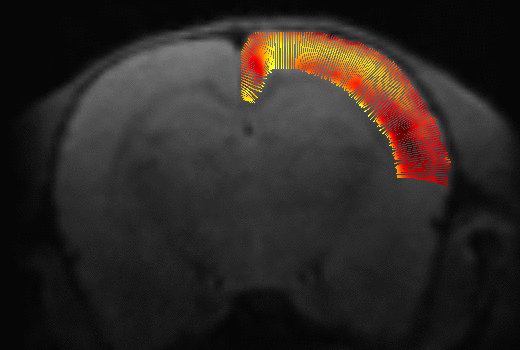
Figura 1: Obtención de los streamlines y sus perfiles de difusión.
Resultados
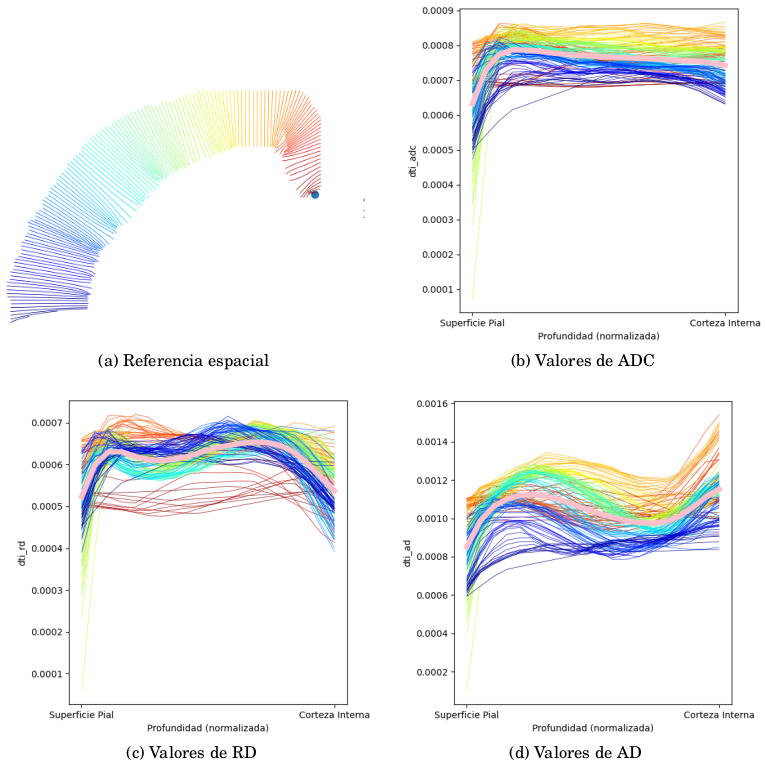
Figura 2: Comparación entre métricas (DTI) para un sujeto control (37A).
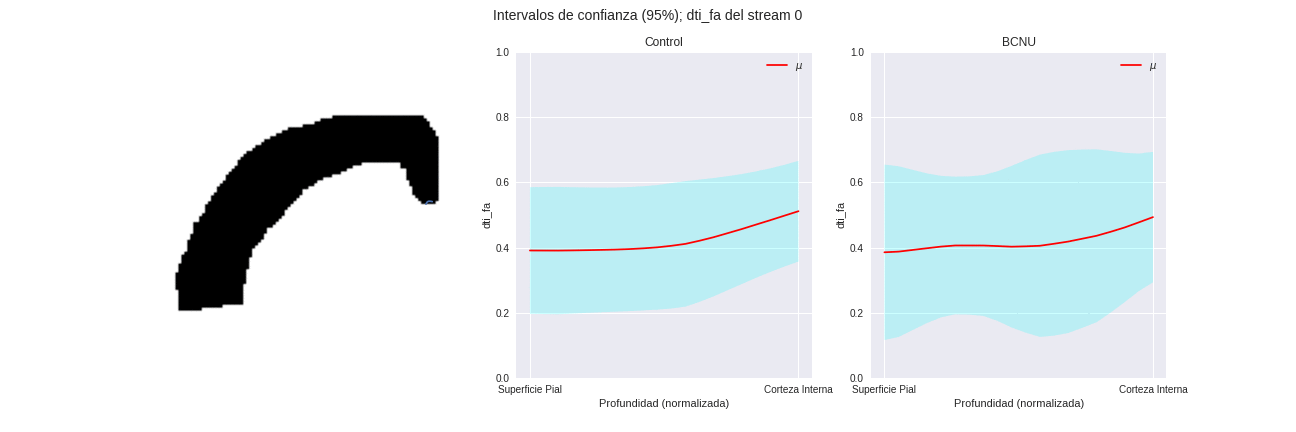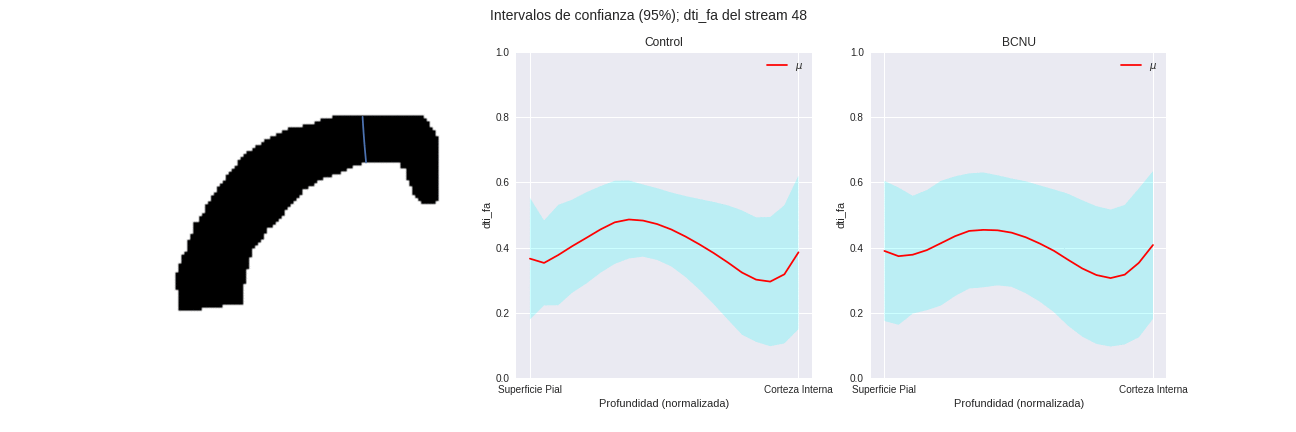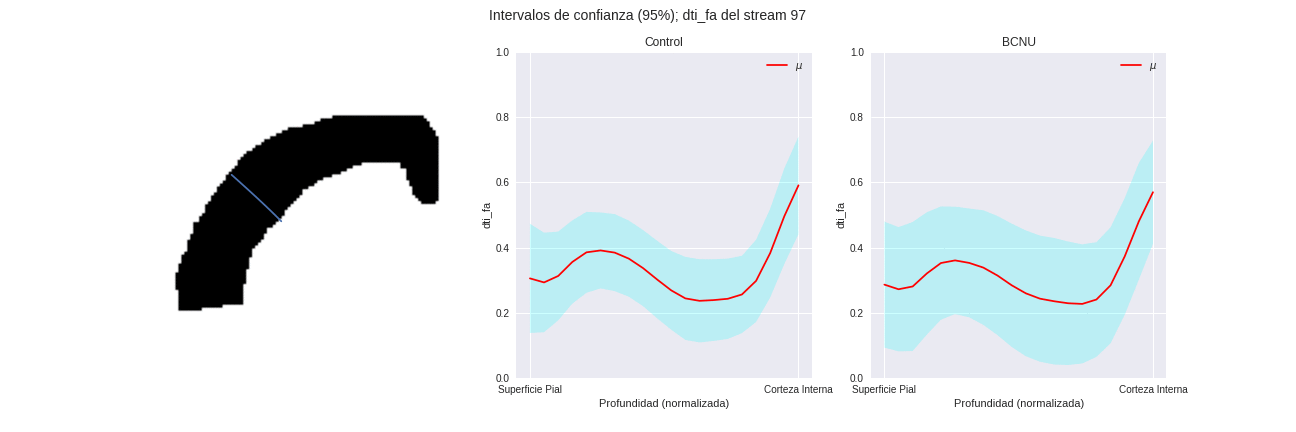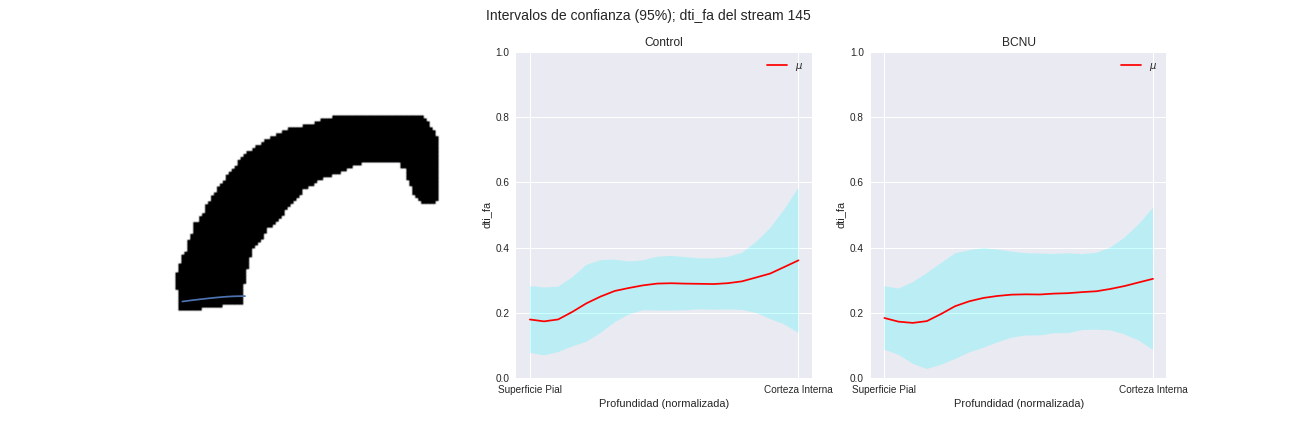
Figura 3: Media e intervalo de confianza de los perfiles de difusión de los grupos, para distintas regiones columnares de la corteza.
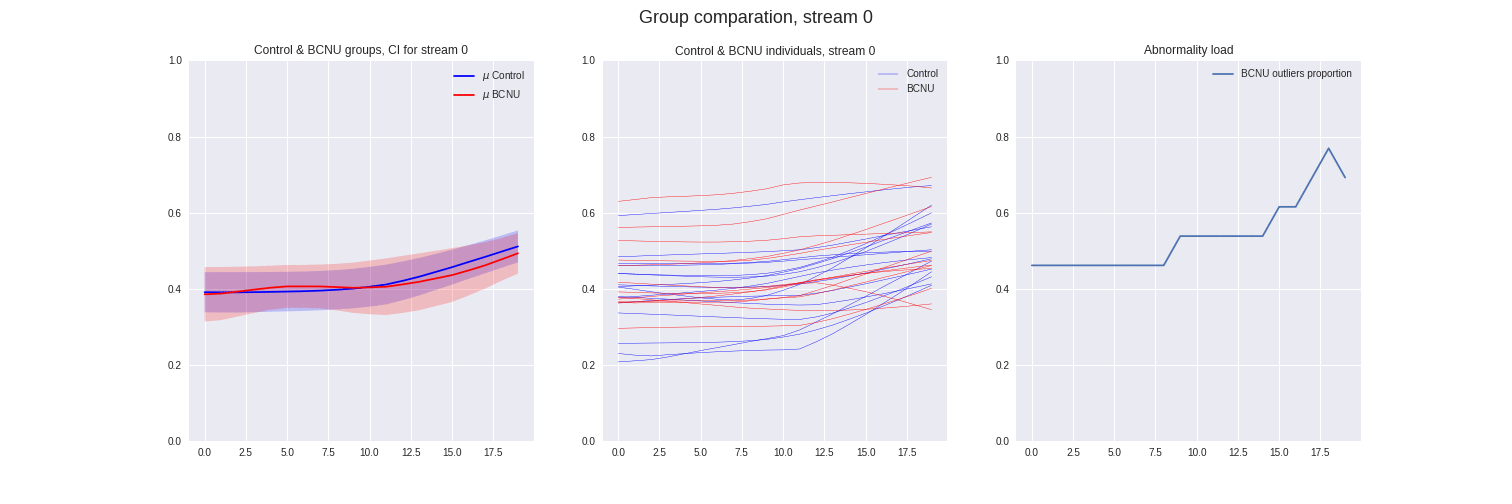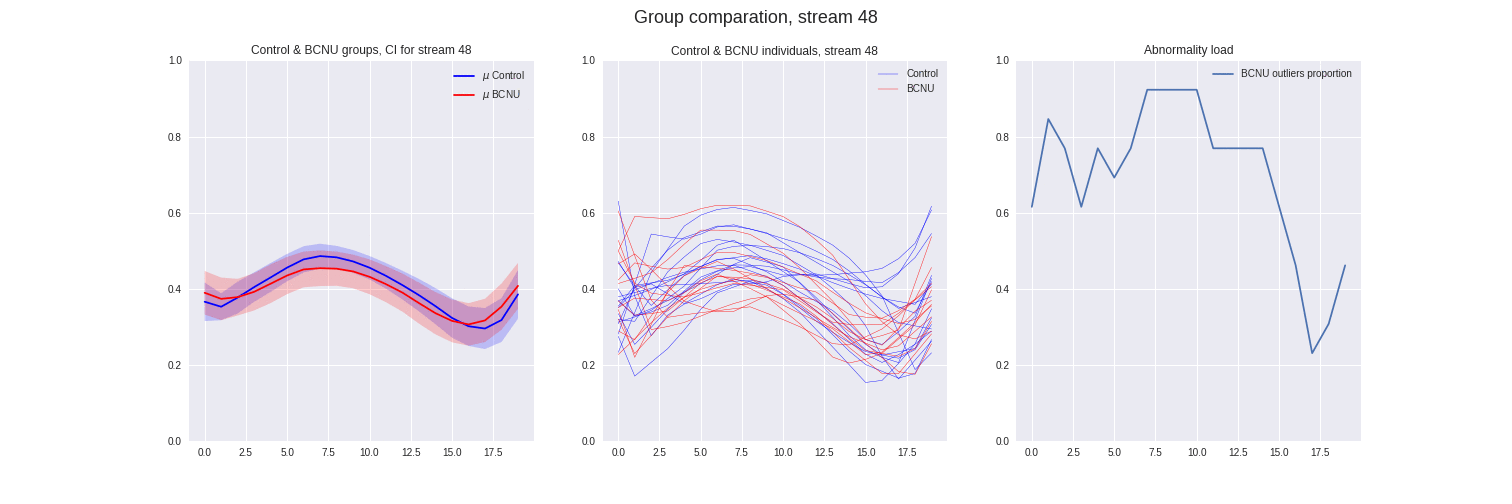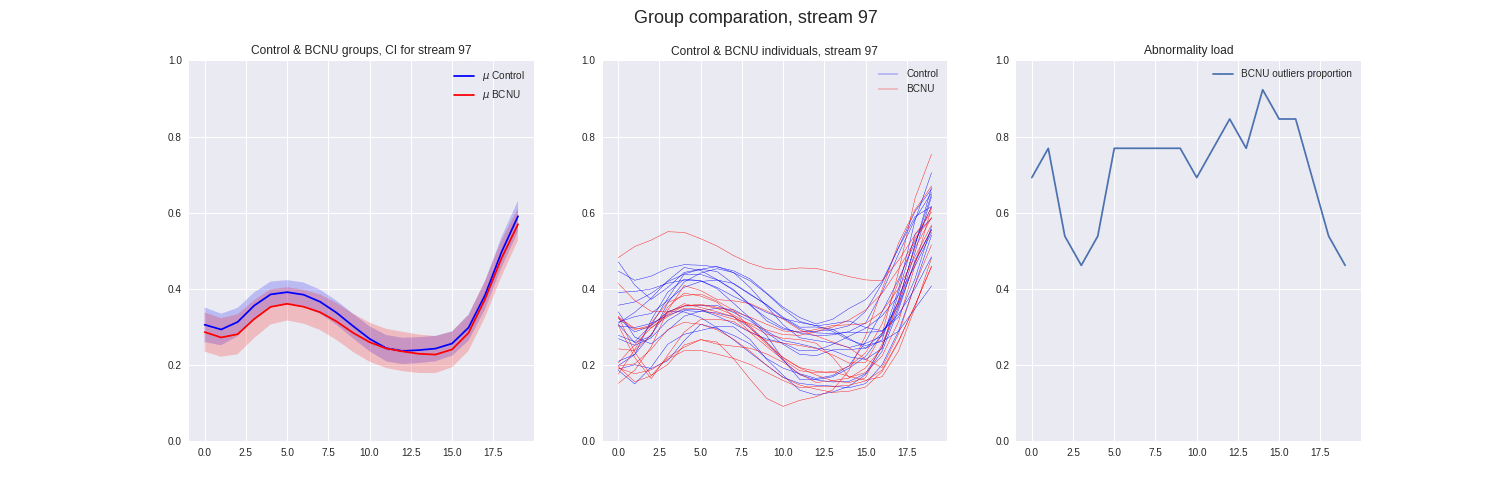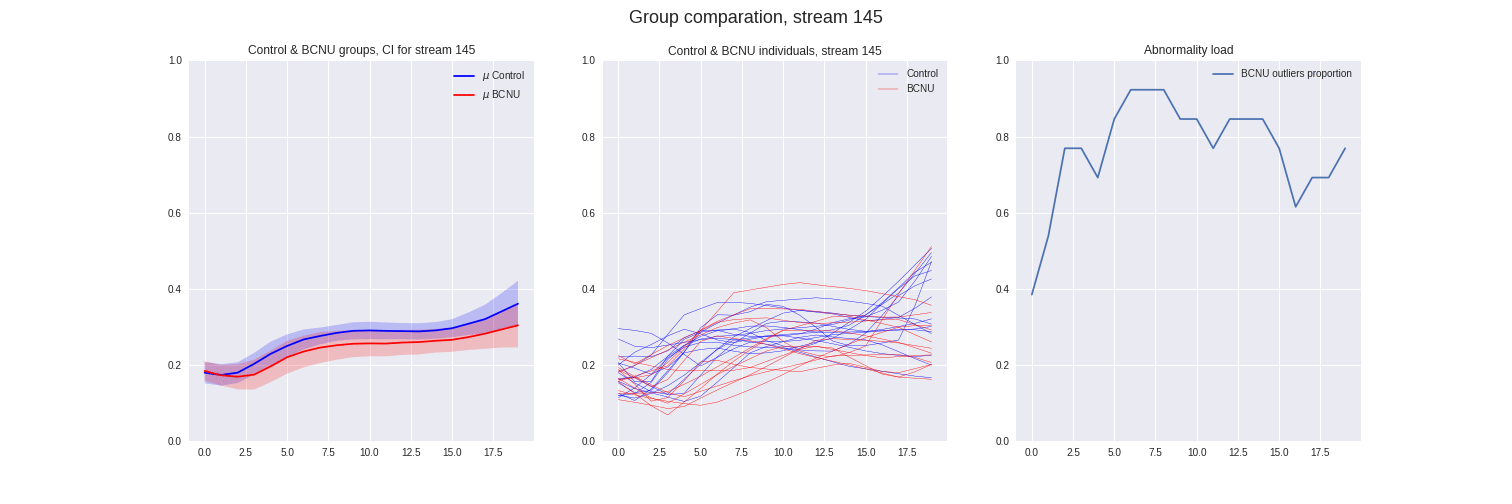
Figura 4: Comparación entre grupos de las streamlines individuales y proporción de sujetos lesionados atipicos.
Conclusiones
Los perfiles de difusión de los streamlines analizados reflejan la capacidad de las IRMd de inferir cambios microestructurales entre regiones de la corteza sana. Teniendo un mejor entendimiento de la cito- y mieloarquitectura cortical normal, será posible mejorar los algoritmos de agrupamiento de streamlines empleados y aumentar la precisión de la discriminación del estado cortical (sano, dañado). La incorporación de modelos de difusión adicionales (CSD, NODDI) permitirá extraer información estructural complementaria para el análisis realizado.
Referencias
Daniel Barazany and Yaniv Assaf. Visualization of cortical lamination patterns with magnetic resonance imaging. Cerebral cortex (New York, N.Y. : 1991), 22:2016–23, 10 2011. doi: 10.1093/cercor/bhr277.
Andrea Bernasconi, Neda Bernasconi, Boris Bernhardt, and Dewi Schrader. Advances in mri for ’cryptogenic’ epilepsies. Nature reviews. Neurology, 7:99–108, 02 2011. doi: 10.1038/nrneurol.2010.199.
Ingmar Blümcke et. al. The clinicopathologic spectrum of focal cortical dysplasias: A consensus classification proposed by an ad hoc task force of the ilae diagnostic methods commission. Epilepsia, 52(1):158–174, 2011. doi: 10.1111/j.1528-1167.2010.02777.x.
E. A. Cavalheiro, N. F. Santos, and M. R. Priel. The pilocarpine model of epilepsy in mice. Epilepsia, 37(10):1015–1019, 1996. doi: 10.1111/j.1528-1157.1996.tb00541.x.
Tharindu Ganepola, Zoltan Nagy, Aurobrata Ghosh, Theodore Papadopoulo, Daniel C. Alexander, and Martin I. Sereno. Using diffusion mri to discriminate areas of cortical grey matter. NeuroImage, 182:456 – 468, 2018. ISSN 1053-8119. doi: https://doi.org/10.1016/j.neuroimage.2017.12.046.
Joanna Kabat and Przemysaw Król. Focal cortical dysplasia - review. Polish journal of radiology / Polish Medical Society of Radiology, 77:35–43, 04 2012.
Sanjay Sisodiya, Susanne Fauser, Judith Cross, and Maria Thom. Focal cortical dysplasia type ii: biological features and clinical perspectives. Lancet neurology, 8:830–43, 10 2009. doi: 10.1016/S1474-4422(09)70201-7.
Jacques-Donald Tournier, Fernando Calamante, David Gadian, and Alan Connelly. Direct estimation of the fiber orientation density function from diffusion-weighted mri data using spherical deconvolution. NeuroImage, 23:1176–85, 12 2004. doi: 10.1016/j.neuroimage.2004.07.037.
